今回は、海の水が塩辛い理由や、なぜ海には塩分が必要なのか、塩分濃度が地球にどのように影響を与えているのかを中心に分かりやすく紹介します。
地球上の水の約97%は海にあります。
意外かもしれませんが、海を構成するすべての水には、実際に塩が含まれているわけではありません。

海水は塩が含まれているから塩辛いんでしょ?

実は、海水をなめたときに感じる塩辛さは、似ていても塩と同じではないのよ。
そして、その理由は、以下のように私たちの惑星が機能するうえで、とても重要なのです。
そもそも塩って何?
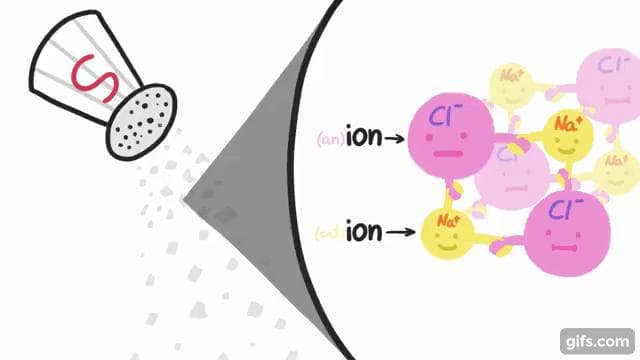
塩とは、ナトリウムイオンや塩化物イオンなど、プラス(+)とマイナス(-)の電気を帯びた粒子「イオン」からなる化合物で、私たちがよく知る塩の結晶は、このイオンからできています。
しかし、一般的に、塩は、水の中に存在することはできません。少なくとも長くは存在できないでしょう。
なぜなら、水の分子にはマイナスの電気を帯びた端とプラスの電気を帯びた端があって、それらが小さな磁石のように働き、塩のプラスとマイナスのイオンを引き離すからです。

それが、コップの水に少量の食卓塩を溶かしたときに起こっていることです。くわしくは「なぜ水はほとんどの物を溶かす万能溶媒なのか?」を参照。
私たちは、コップの中の水を「塩水」と呼んでいますが、実際には塩が入っているわけではなく、イオンがあるだけなのです。海の水が塩辛いのは、このイオン濃度によるものです。
そして、私たちが水の「塩分」を測定するときに使う「塩分濃度」は、これらのイオンの濃度をいいます。
では、海水の塩分濃度が長い年月が経過してもほぼ一定なのはなぜなのでしょうか?
海の塩分濃度は河川や雨水で薄まらないのか?
もし、コップに塩をたくさん入れたら、イオンの量が多すぎて、水の分子がイオンを引き裂くよりも速いペースでイオン同士が互いにぶつかって再結晶化します。そうなると、塩(の結晶)が積み重なることになります。
実のところ、その再結晶化は、死海のように自然界で時折発生しています。
死海では、絶えず蒸発し続ける湖に、河川から洗れ込んだイオンの行き場がありません。行き場を失ったイオンは、自然界で再結晶化を起こすことがあるのです。
しかし、海では異なります。雨水をはじめ、陸上で岩石を溶かした河川がイオンを海に運び込んできたり、火山活動や海底の堆積物の溶解などによって、海にはイオンが絶えず追加されているにもかかわらず、それを希釈する水の量も十分にあり、イオンも常に除去されているからです。
波に打ち上げられて陸に上がるイオンもあれば、堆積物として海底に溶け込むものや、海洋生物によって貝殻を作る時に取り込まれるイオンもあります。また、多くは海底の熱水噴出孔に吸収されて、地球の地殻に取り込まれます。
海に入るイオンの量と出ていく量がうまく釣り合っている結果、海のイオン濃度、つまり「塩分濃度」は、時が経過してもほぼ一定に保たれているのです。
そして、そのイオンのおかげで、海は健全に保たれているのです。
温度や塩分濃度のちがいによって地球の水は循環している
海水の塩分濃度は一定ですが、地球上のどこでも同じというわけではありません。
たとえば、寒い極域で、海水が凍って氷になるときは、イオン(塩分)は押し出せれて真水だけが凍るのでそこの海水のイオン密度(塩分濃度)は高くなります。
密度が高い海水は、重いので海の下に沈み込みこむため、暖かい海水を赤道方面から引き込みます。
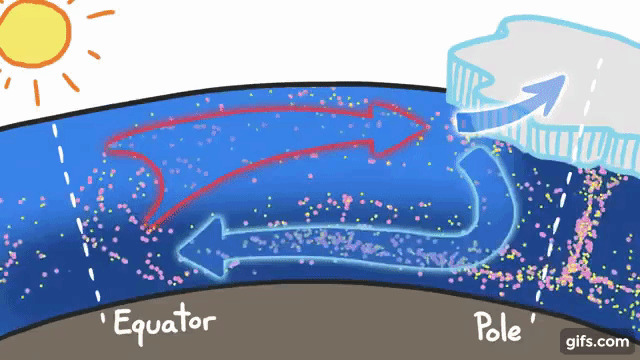
この塩分濃度の違いによる海水の交換のおかげで、栄養素と酸素が世界中の海に移動し、極域の海水を暖めたり、赤道付近の海水冷やしたりのに役立ちます。
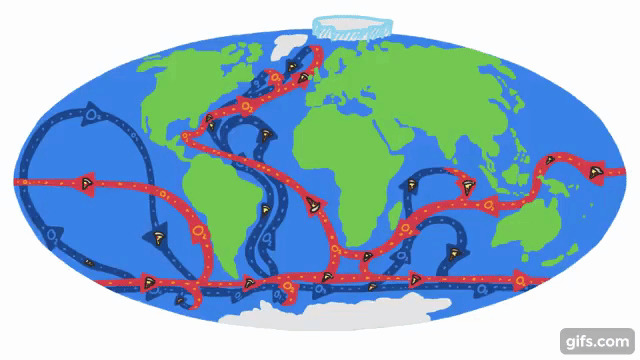
このように、海水の温度や小さな塩分濃度の違いによる影響を受けて、海は長い年月をかけて地球規模で循環し続けているのです。
地球の水は、「海水(液体)が太陽熱で温められて水蒸気になり、大気によって冷やされて雲、そして雨として降りそそぐ」というように、陸や空で固体や液体、水蒸気に姿を変えながら、ほぼ一定量に保たれています。
新しく加わったり、除去されたりすることがあまりないので、川や雨の水で海水の濃度が薄くなることはないのです。
イオン濃度の変化が続けば、海の水の循環が乱れ、海洋生物に必要な酸素や栄養分を運ぶ機能を維持し続けるのは難しくなるでしょう。


