水は、沸点と呼ばれる温度(100℃)で沸騰し、液体から水蒸気(気体)になります。
しかし、雨の日の後は、100℃ではないにも関わらず、水たまりは少しずつ蒸発します。
いったい水はなぜ、どのようにして低温で蒸発するのでしょうか?
これは、各水分子がもつエネルギー量にはばらつきがあり、温度や湿度などによって十分な運動エネルギーを得た一部の水分子が、水素結合を壊して蒸発しているからです。
これを理解するために、以下より水分子の性質と結合方法に注目してみていきましょう。
水分子の構造
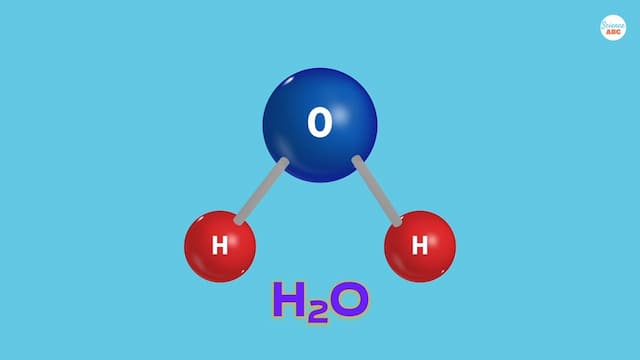
水分子(H2O)は、1つのO(酸素原子)と2つのH(水素原子)からできています。
これらの水分子は、共有結合(OとHがお互いに電子を貸し借りした結合方法)によってお互いにしっかりと結びついています。
原子と原子の間で電子を共有した「共有結合」は強力で、水分子を安定して保つのに役立っているのです。
次に、それぞれの水分子同士の間での結びつきについて話しましょう。
水分子同士の結びつき(分子間結合)
それぞれの分子は、お互いに「分子間力」と呼ばれる共有結合よりも弱い引力によって引かれあっています。
そして、この分子の結びつき方(分子間結合)は、それらがお互いにどのように作用するかを決定します。
分子間結合の1つのタイプは、水分子に見られる特殊な水素結合です。
水分子はOとHからできていますが、その構造上、それぞれの原子では、電子を共有している部分の反対側に電気的な偏りが生まれてしまいます。
つまり、1つの水分子のなかで、Hはわずかにプラスに、Oはわずかにマイナスの電気を帯びているのです。
すると、隣り合った水分子の端の部分で、プラスのHとマイナスのO原子の部分が互いに引き合って結びつきます。これが水素結合と呼ばれるものです。
水から水蒸気への変化
水素結合は共有結合より弱いとはいえ、それでも水の性質において重要な役割を果たします。
これらの結合は、
高い比熱容量(一定の条件で、温度上げるのに必要な熱量)
高い蒸発熱(気化熱:液体を気体に変えるのに必要な熱)
の原因となります。
気化熱が高いということは、水を液体から気体(水蒸気)に変えるのに多くのエネルギーが必要であることを意味します。
水が100℃に加熱されると、水分子は水素結合を壊すのに十分なエネルギーを得て、沸騰と呼ばれるプロセスを通じて水蒸気(気体)として放出できるようになります。
一方、低温で起こる水たまりの蒸発もまた、水素結合を壊すという同じ原理に基づいています。
さらに以下に、水はなぜ、そして、どのようにして低温で蒸発するのかを詳しくみていきましょう?
なぜ水たまりは低温で蒸発するのか?
実は、すべての水分子がいつでも同じ量のエネルギーを持っているわけではありません。
物質の温度は本質的に、その分子がもつ平均エネルギー量です。
一部の水分子は他のものよりもエネルギーが高く、なかにはエネルギーが低いものもあります。
これは分子のランダムな動きと相互作用によるものです。
このプロセスは蒸発と呼ばれ、周りの温度が沸点に達していない場合でも発生するのです。
水の蒸発しやすさには、温度、湿度、風など、いくつかの要因が影響します。
温度が高くなると蒸発速度が速くなりますが、湿度が高く空気が動かないと蒸発速度が遅くなります(空気がすでに水蒸気で飽和している場合、蒸発は止まります)。
ただし、沸騰は温度が沸点に達すると起こりますが、蒸発は水分子間のエネルギー分布がランダムであるため、どの温度でも起こります。
特に太陽の熱やその他の理由によって液体の最上層で温められた一部の水分子は十分な運動エネルギーを得やすく、温度が100℃ではなくても、水素結合を壊して蒸発し、大気中に逃げ出すのです。




